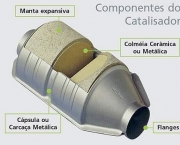
O catalisador é responsável para fazer a catálise, que consiste no aumento da taxa de reação química devido à participação da substância. Um catalisador pode participar em várias transformações químicas. O efeito pode variar devido à presença de outras substâncias conhecidas como inibidores ou promotores.
Reações de catalisador têm menor energia de ativação (taxa de limitação de energia livre de ativação) do que a reação não catalisada correspondente, resultando na taxa de reação elevada à mesma temperatura. No entanto, a explicação mecanicista da catálise é complexa.
Os catalisadores podem afetar de modo favorável o ambiente da reação ou se liga aos reagentes a polarizar as ligações. Por exemplo, catalisadores ácidos às reações de compostos, ou forma intermediários específicos que não são produzidos de modo natural ou provoca a dissociação dos reagentes para as formas reativas, tais como hidrogênio na hidrogenação catalítica.
Cineticamente, as reações catalíticas são reações químicas, ou seja, a velocidade de reação depende da frequência de contato dos reagentes no passo determinante da velocidade.
Normalmente, o catalisador participa neste passo mais lento e as taxas são limitadas pela quantidade e “atividade”. Em catálise heterogênea, a difusão dos reagentes para a superfície e a difusão dos produtos a partir da superfície pode ser determinante na velocidade.
Um catalisador à base de nano material é exemplo de catalisador heterogêneo. Acontecimentos análogos associados com substrato de ligação e de dissociação do produto se aplicam aos catalisadores. Embora os catalisadores não sejam consumidos pela própria reação, eles podem ser inibidos, desativados ou destruídos por processos secundários.
Em catálise heterogênea os processos secundários típicos incluem coque, onde o catalisador fica coberto por poliméricos e produtos secundários. Adicionalmente, os catalisadores heterogêneos se dissolvem a solução em sistema sólido-líquido.
A produção da maioria dos produtos químicos de modo industrial importantes envolve a catálise. Do mesmo modo, grande parte dos processos significativos é catalisada. Pesquisa no campo tem importância na ciência aplicada e envolve áreas da química, nomeadamente em química organometálica e ciência dos materiais.
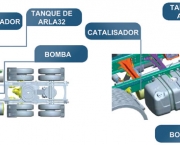
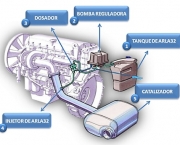
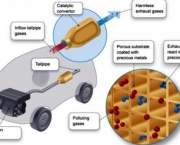
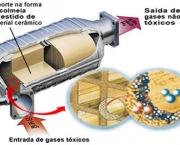
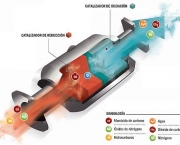
Catálise é relevante para aspectos da ciência ambiental. Por exemplo, o conversor catalítico em automóveis e as dinâmicas do buraco de ozônio. Reações catalíticas são preferidas na química verde devido à diminuição da quantidade de resíduos gerados em oposição às reações estequiométrica no qual todos os reagentes são consumidos e mais produtos secundários formados. O catalisador mais comum é a de iões de hidrogênio (H +). Catalisadores chamados enzimas são importantes na biologia.
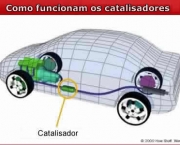
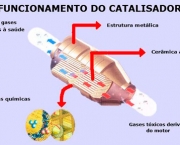
Como Funciona o Catalisador?
Um catalisador funciona fornecendo via de reação alternativa para o produto. A velocidade aumenta à medida que esta via alternativa inferior tem uma energia de ativação além do percurso não mediado pelo catalisador. A desproporção de peróxido de hidrogênio produz água e oxigênio.
A reação é preferível na medida em que os produtos são mais estáveis do que àqueles existentes na partida, embora a reação não catalisada seja lenta. Na realidade, a decomposição do peróxido de hidrogênio é tão lenta que as soluções de peróxido de hidrogênio estão disponíveis no comércio.
A reação é afetada pelos catalisadores, tais como dióxido de manganês, por exemplo. Após a adição de uma pequena quantidade o peróxido de hidrogênio reage rapidamente.
Este efeito é visto pela efervescência de oxigênio. O dióxido de manganês não é consumido na reação, e, portanto, pode ser recuperado e reusado múltiplas vezes. Deste modo, o dióxido de manganês catalisa esta reação.
Quais os Principais Princípios do Catalisador?
Em termos gerais os catalisadores reagem com um ou mais reagentes para formar intermediários a formar o produto final da reação no processo de regeneração. No seguinte esquema, C representa o catalisador, X e Y são os reagentes e Z é o produto da reação de X e Y:
- 01: X + C → X C
- 02: Y + X C → XY C
- 03: XY C → C Z
- 04: C Z → C + Z
Reação geral: X + Y → Z
Como o catalisador é regenerado por reação, por vezes são necessárias apenas pequenas quantidades para aumentar a taxa da reação. Na prática, no entanto, os catalisadores são consumidos em processos secundários.
Exemplo do processo aconteceu em 2008, quando investigadores dinamarqueses revelaram pela primeira vez a sequência de eventos ao oxigênio e hidrogênio que se combinam sobre a superfície de dióxido de titânio para produzir água.
Com uma série de lapso de tempo de microscopia de tunelamento, eles determinaram que as moléculas passam por adsorção, dissociação e difusão antes de reagir.
Reação Energética
Diagrama de energia potencial genérica mostra o efeito do catalisador em reação química exotérmica hipotética de X + Y para dar Z. A presença da ação abre uma via de reação diferente com energia de ativação inferior. Resultados finais nas termodinâmicas gerais são os mesmos.
Catalisadores de trabalho fornecem mecanismo (alternativo) envolvendo diferente estado de transição e menor energia de ativação. Consequentemente, mais colisões moleculares e energia são necessárias para alcançar o estado de transição.
Catalisadores podem permitir reação que seriam bloqueadas ou retardadas por barreira cinética. O catalisador pode aumentar a velocidade de reação ou seletividade ao permitir ação às temperaturas mais baixas. Este efeito pode ser ilustrado com uma distribuição de Boltzmann e perfil de energia.
Nas catalisada reação elementar os catalisadores que não alteram a extensão de uma reação não têm efeito sobre o equilíbrio químico porque a taxa e reação inversa são tanto afetadas.
O fato de que um catalisador não altera o equilíbrio é uma consequência da segunda lei da termodinâmica. Suponha que se deslocou um equilíbrio, o sistema resultaria em reação a se deslocar para o novo equilíbrio, produzindo energia.
A produção de energia é um resultado necessário uma vez que as reações são espontâneas. Se não houver nenhuma barreira de energia, não há necessidade de catalisar.
Em seguida, a remoção resultaria também na reação de produção de energia, ou seja, adição ao processo inverso. Assim, um catalisador que poderia mudar o equilíbrio seria uma máquina de movimento perpétuo, uma contradição com as leis da termodinâmica.
Se o catalisador não alterar o equilíbrio, então deve ser consumido como a reação reagente.